Toggle Dropdown
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ВИРУСВАКЦИНА ПРОТИВ БОЛЕЗНИ АУЕСКИ КУЛЬТУРАЛЬНАЯ СУХАЯ. ТЕХНИЧЕСКИЕ УСЛОВИЯ
ГОСТ 23050-2012
Virusvaccina against Aujeszky disease cultural dry.Specification
Дата введения 1 июля 2014 года
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены".
1. Разработан Федеральным государственным бюджетным учреждением "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГБУ "ВГНКИ").
2. Внесен Федеральным агентством по техническому регулированию и метрологии Российской Федерации.
3. Принят Межгосударственным советом по стандартизации, метрологии и сертификации (протокол N 54-П от 3 декабря 2012 г.).
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166) 004-97
|
Код страны по МК (ИСО 3166) 004-97
|
Сокращенное наименование национального органа по стандартизации
|
|
Армения
|
AM
|
Минэкономики Республики Армения
|
|
Беларусь
|
BY
|
Госстандарт Республики Беларусь
|
|
Киргизия
|
KG
|
Кыргызстандарт
|
|
Молдова
|
MD
|
Молдова-Стандарт
|
|
Россия
|
RU
|
Росстандарт
|
|
Таджикистан
|
TJ
|
Таджикстандарт
|
|
Узбекистан
|
UZ
|
Узстандарт
|
4. Приказом Федерального агентства по техническому регулированию и метрологии от 28 июня 2013 г. N 314-ст введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2014 года.
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет.
Настоящий стандарт распространяется на культуральную сухую вирусвакцину против болезни Ауески (далее - вакцина), изготовленную из аттенуированного штамма ВГНКИ вируса болезни Ауески, полученного в однослойной культуре клеток куриных эмбрионов и подвергнутого лиофильному высушиванию.
Вакцина предназначена для профилактической иммунизации свиней, крупного рогатого скота и овец против болезни Ауески.
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 12.0.004-90 Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.008-76 Система стандартов безопасности труда. Биологическая безопасность. Общие требования
ГОСТ 12.2.003-91 Система стандартов безопасности труда. Оборудование производственное. Общие требования безопасности
ГОСТ 12.3.002-75 Система стандартов безопасности труда. Процессы производственные. Общие требования безопасности
ГОСТ 12.4.011-89 Система стандартов безопасности труда. Средства защиты работающих. Общие требования и классификация
ГОСТ 17.0.0.01-76 Система стандартов в области охраны природы и улучшения использования природных ресурсов. Основные положения
ГОСТ 17.2.3.02-78 Охрана природы. Атмосфера. Правила установления допустимых выбросов вредных веществ промышленными предприятиями
ГОСТ 3164-78 Масло вазелиновое медицинское. Технические условия
ГОСТ 6038-79 Реактивы. D-глюкоза. Технические условия
ГОСТ 9142-90 Ящики из гофрированного картона. Общие технические условия
ГОСТ 9293-74 (ИСО 2435-73) Азот газообразный и жидкий. Технические условия
ГОСТ 10157-79 Аргон газообразный и жидкий. Технические условия
ГОСТ 12301-2006 Коробки из картона, бумаги и комбинированных материалов. Общие технические условия
ГОСТ 12303-80 Пачки из картона, бумаги и комбинированных материалов. Общие технические условия
ГОСТ 14192-96 Маркировка грузов
ГОСТ 17206-96 Агар микробиологический. Технические условия
ГОСТ 24061-2012 Средства лекарственные биологические лиофилизированные для ветеринарного применения. Метод определения массовой доли влаги
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Общие технические условия
ГОСТ 28085-89 Препараты биологические. Метод бактериологического контроля стерильности
ГОСТ 29230-91 (ИСО 835-4-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть IV. Пипетки выдувные
Примечание. При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3. Технические требования
3.1. Вакцина должна соответствовать требованиям настоящего стандарта и изготавливаться в соответствии с технологическим регламентом производства.
Показатели качества вирусвакцины
|
Наименование показателя
|
Характеристика и норма
|
|
Внешний вид и цвет
|
Гомогенная сухая пористая масса бело-желтого цвета с розоватым оттенком
|
|
Наличие посторонней примеси, трещин ампул или флаконов, нарушение маркировки
|
Не допускается
|
|
Массовая доля влаги, %
|
1 - 4
|
|
Время регидратации, мин
|
1 - 2
|
|
Контаминация бактериальной, грибной микрофлорой
|
Не допускается
|
|
Контаминация микоплазмами
|
Не допускается
|
|
Активность по титру инфекционности в культуре клеток куриных эмбрионов, 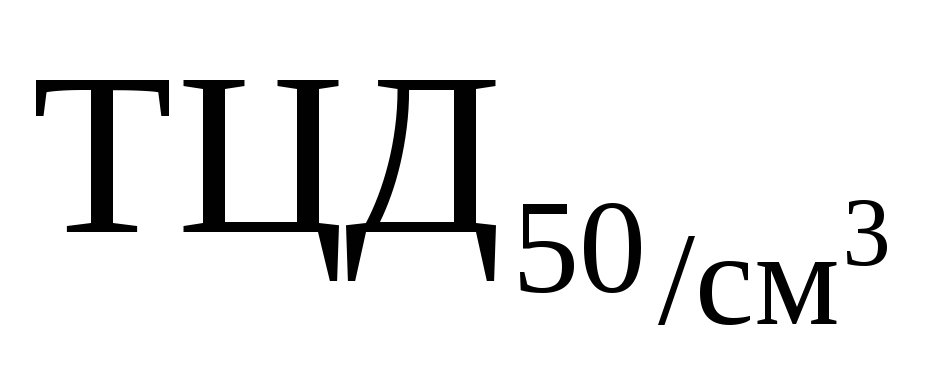 , не менее , не менее
|
10 5,0
|
|
Активность по титру инфекционности для кроликов, 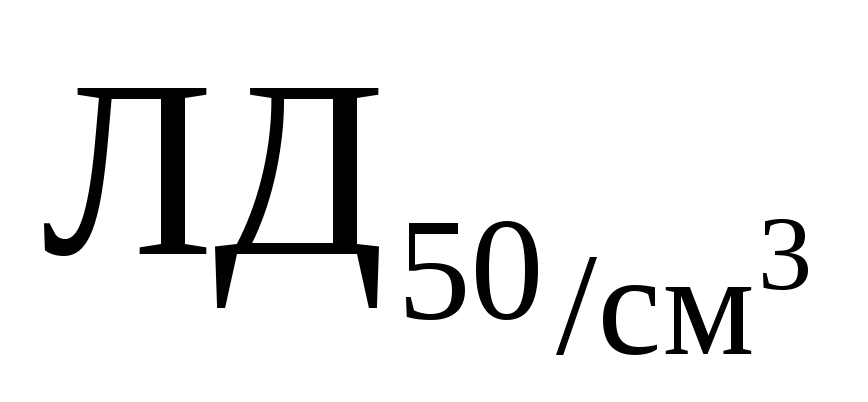 , не менее , не менее
|
10 3,0
|
|
Безвредность
|
Должна быть безвредной для овец в возрасте от года до пяти лет
|
|
Иммуногенная активность
|
Должна быть иммуногенной для овец в возрасте от года до пяти лет
|
|
Примечания.
1. ЛКД 50 - 50%-ная летальная доза для кроликов.
2. Иммуногенную активность вакцины проверяют в каждой пятой серии вакцины.
3. Наличие посторонней примеси проверяют в ресуспензированной вакцине.
|
3.3. Фасование и лиофилизация
Вирусосодержащую жидкость смешивают со средой высушивания в соотношении 1:1 и расфасовывают в стерильные ампулы по 2 см3 или флаконы по 4 см3 . Ампулы и флаконы с вакциной замораживают при температуре минус (40 +/- 1) °C и подвергают лиофильной сушке. После окончания лиофилизации ампулы с вакциной заполняют инертным газом - азотом по ГОСТ 9293 или аргоном по ГОСТ 10157 и запаивают, а флаконы заполняют стерильным осушенным воздухом или инертным газом, закрывают резиновыми пробками и обжимают алюминиевыми колпачками.
3.4. Упаковывание и маркирование














